내추럴킬러T(NKT) 세포는 세포 표면에 내추럴킬러(NK) 세포의 마커분자(CD161)와 T세포수용체(TCR) 분자를 발현해 NK세포와 T세포 모두 성질을 가진 세포로 동정됐다.
NKT 세포에는 비고전적(nonclassical) 주요 조직적합항원등급I(MHCclass I)인 CD1d 분자에 구속성이 있는 타입I와 타입II 및 불구속성의 서브셋이 보고되었다.CD1d 구속성 NKT 세포 중 불변 TCR 사슬을 가진 invariant NKT(iNKT) 세포를 타입 I, 반면 다양한 TCR 사슬을 가진 CD1d 구속성 NKT 세포는 타입 II로 분류된다.
마우스 iNKT 세포에서 불변 TCRα 사슬은 Vα14-Jα18이고 TCRβ 사슬은 다양성이 있으며 Vβ8.2, Vβ7, Vβ2 순으로 많다.인간 NKT 세포에서는 불변 TCRα 사슬은 Vα24-Jα18이고 TCRβ 사슬도 Vβ11로 한정되어 있다.
또 개에서도 iNKT 세포가 동정되어 마우스 Vα14-Jα18과 인간 Vα24-Jα18에 상동성이 높은 불변 TCRα 사슬이 유전자 클로닝되고 있다(그림 1).
iNKT 세포의 비율은 말초혈 림프구 중에서는 마우스에서 1% 내외, 사람에서는 0.01-1%로 낮다[2]. 그러나 간이나 골수에는 많이 존재하는 것으로 알려져 있다[3,4].

iNKT 세포리간드 화합물
iNKT 세포를 활성화하는 대표적인 리간드 화합물은 알파-galactosyl ceramide(α-GalCer)이다. 알파-GalCer의 시드는 천연물 화합물이며 오키나와 근해에 서식하는 해면(agelas mauritianus)에서 추출되었다[5].그 후 담암 누드마우스를 이용한 항종양 효과를 지표로 알파-GalCer(KRN7000)가 화학합성되었다[6].
α-GalCer는 항원제시세포 상에 발현하는 CD1d 분자에 제시되어 iNKT 세포를 특이적으로 활성화하고 Th1 응답과 관련된 IFN-γ, 또한 Th2 응답과 관련된 IL-4나 IL-13 등의 다양한 사이토카인을 생산함으로써 자연면역과 획득면역의 가교 역할을 하고 있다[7].
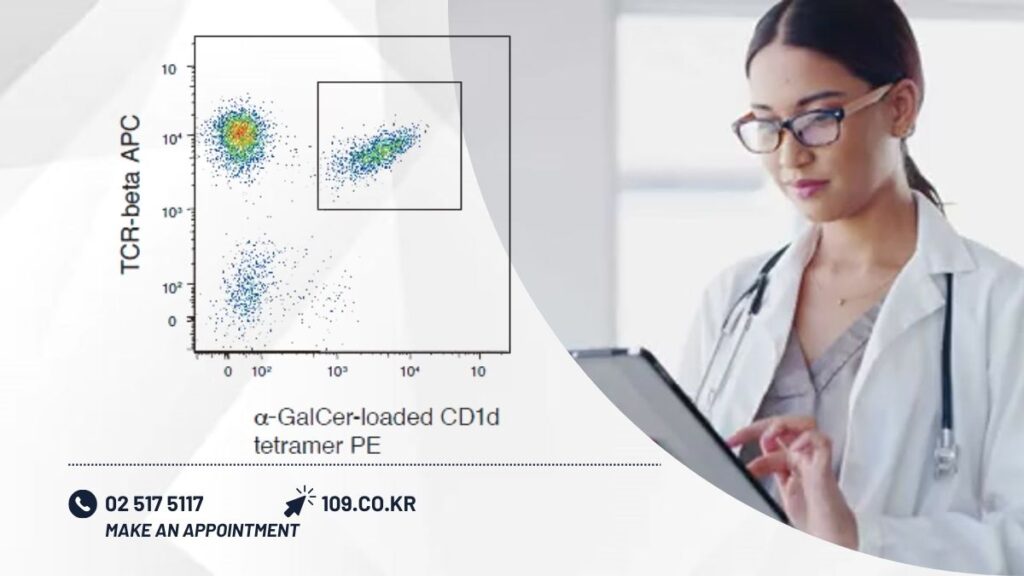
α-GalCer를 C57BL6 마우스의 미정맥으로부터 투여 3일 후에는 비장 중에 B220 음성TCR 양성αGalCer/CD1d 테트라머 양성의 iNKT 세포가 현저하게 인정된다(그림2).
iNKT 세포 서브세트
iNKT 세포는 다양한 서브셋으로 분류할 수 있는 것으로 보고됐다.인간에서는 CD4 음성 iNKT 세포는 IFN-γ를 주로 생산하는 반면 CD4 양성 iNKT 세포는 Th1과 Th2 양쪽 사이토카인을 생산하는 능력이 있다[8,9].
또한 마우스에서도 CD4 음성 iNKT 세포는 CD4 양성 iNKT 세포보다 Th1 사이토카인 생산 우위이면서 높은 항종양 활성을 보이는 것으로 보고되었다[10]. 또한 마우스 iNKT 세포는 전사 인자의 발현에 따라 군분할 수 있다는 것도 제창되었다[11].
Th2의 마스터 유전자인 Gata-3를 발현하는 iNKT 세포는 IL-12 수용체, IL-15 수용체, CXCR3를 세포 표면에서 발현하고 IFN-γ와 IL-4를 모두 생산하며(타입 1), 또 Th1의 마스터 유전자인 T-bet을 발현하는 iNKT 세포는 IL-25 수용체(IL-17RB), CCR4를 세포 표면에서 발현하며 IL-4와 IL-13을 생산한다(타입 2).
또한 RORγt를 발현하는 iNKT 세포는 IL-23 수용체와 CXCR6를 발현해 IL-17A나 IL-22를 생산한다(타입3). iNKT 세포 타입2는 IL-25에서 유발되는 마우스 기도 과민증의 악화와 관련이 있다. 12-14)
또한 iNKT 세포를 정의하는 공통 전사 인자로서 PLZF의 발현이 보고되었다[15]. 또한 PLZF 발현이 없는 iNKT 세포가 지방 조직 중에 존재하고 있으며, 주로 IL-2와 IL-10을 생산하는 등의 억제성 기능을 갖는 것도 보고되었다[16].이상과 같은 다양한 iNKT 세포 서브셋을 해석하기 위해서는 플로우 사이트 미터에 의한 고도의 세포 분석·소팅 기술이 요구된다.
α-GalCer자극에 의한 iNKT세포의 변화
생체 내에서는 다양한 iNKT 세포 서브셋이 분화·증식해 감염 방어나 항종양 작용을 제어하고 있음이 시사되지만 내재성의 어떤 화합물이 리간드가 되어 iNKT 세포를 활성화하고 있는지는 미해결이다.
생체 내에 존재하는 알파-GalCer 유사 화합물이 동정되었지만 CD1d 상에 제시된 화합물과 iNKT 세포 상의 TCR의 친화성은 알파-GalCer보다 20배 이상 낮은 것으로 보고되었다[17].이 보고는 알파-갈서와 같은 강한 친화성을 가진 리간드 화합물로는 생체 내 iNKT 세포를 정상적으로 제어할 수 없을 가능성을 시사한다.
사실 알파-GalCer 수용액의 마우스 정맥 내 투여에서는 1차 투여 후에 인정되는 혈중에서의 IFN-γ 생산이 2차 이후 투여 후에는 인정되지 않는다는 것이 보고되었다[18-20].iNKT 세포의 불응답(아나디)이라고도 할 수 있는 현상은 알파-GalCer의 임상시험에서도 인정되고 있다[21].
하지만 이후 iNKT 세포의 항종양 활성, 특히 IFN-γ의 생산을 증강시키기 위한 리간드 화합물 탐색 연구도 거의 모든 것이 CD1d와 TCR의 친화성을 높이는 설계가 이뤄졌다.
α-GalCer보다 높은 친화성을 갖는 리간드 화합물 DB06-1을 1회 투여 후 1개월째에 2차 투여해도 IFN-γ의 생산은 회복되지 않았지만 반대로 IL-10 생산은 우위로 상승하는 것으로 보고되었다[22]. 이 iNKT 세포의 아나디 유도 메커니즘으로서 골수 유래가 있는 어떤 종류의 세포가 관여하고 있음이 시사되고 있다[23].
iNKT 세포의 면역제어 기능과 그 응용
iNKT 세포의 항종양 활성은 알파-GalCer 및 기타 많은 고친화성 리간드 화합물의 정맥 내 단회 투여에서만 인정될 가능성이 시사되었으나, 한편 면역억제가 필요한 알레르기·자가면역질환이나 이식 영역에서는 여러 차례 투여를 통한 iNKT 세포의 제어기능이 중요한 역할을 나타내는 것으로 보고되었다.
예를 들어 알파-갈서 수용액을 마우스에 3회 투여함으로써 iNKT 세포의 사이토카인 생산은 IL-10 우위에 편중되고 면역관용성 DC 증식도 인정받았다.우리는 리포좀화α-GalCer 리포좀 제제를 개발해, 1회 투여로도 iNKT 세포의 IL-10 생산을 증강해, IFN-γ 생산을 억제하는 작용기전을 해명했다(그림3).
리포좀화 알파-GalCer는 마우스 꼬리 정맥 내에 투여 후 비장변연대 CD21hiCD23lowB세포에 우선적으로 도입되었으며, iNKT세포와의 만남을 통해 B세포로부터의 IL-10 생산량은 iNKT세포로부터의 IL-10 생산을 훨씬 웃도는 것을 밝혔다[24].
그 후 비장 내에서는 면역관용성 CD11clow CD45RBhi 세포가 증식하고 반대로 컨벤셔널한 CD11chi DC가 감소하는 현상을 발견하여 CD11clow CD45RBhi 세포와 RAG 결손 마우스 유래 CD4+ CD25-T 세포와의 in vitro 배양계에서는 Foxp3+제어성 T세포(Treg)로의 분화를 인정하였다[23].
또한 IgE 생산 알레르기 마우스에 대한 리포좀화 알파-GalCer의 invivo에서의 효과는 항원 감작 3일 전 단회 투여에 의해 항원 특이적 IgE와 IgG 양쪽 항체 생산이 우위에 억제되었다[24].
이상의 결과로부터, 데터젠트로 수용화한 알파-GalCer의 복수회 투여에 의해 유도되는 iNKT 세포의 면역 제어 기능을, 리포좀화 알파-GalCer는 1회 투여로 끌어낼 수 있음이 밝혀졌다.

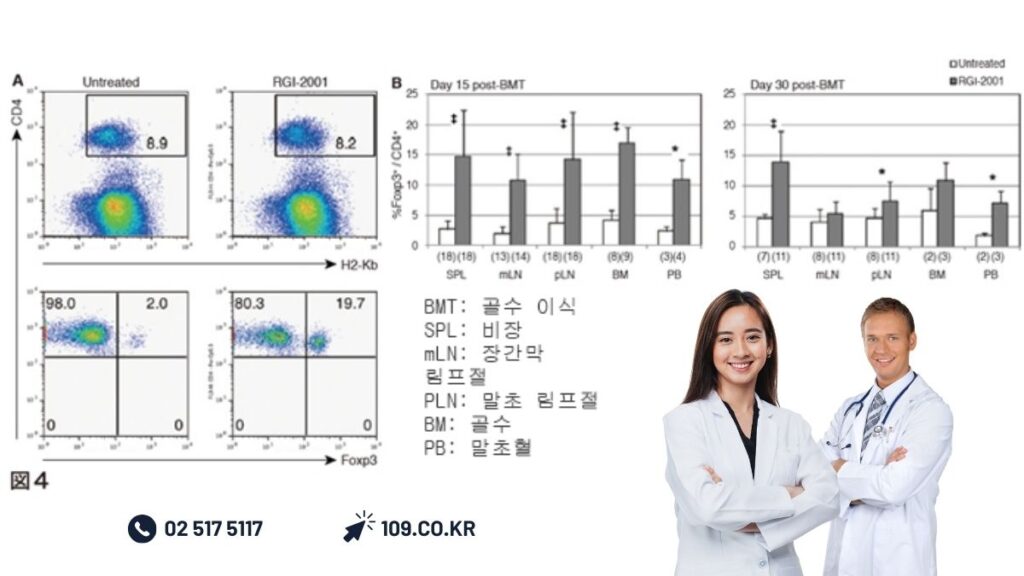
리포좀화 알파-GalCer의 임상 응용은 이식 분야에서 선행되고 있다.이식편대숙주병(GVHD) 발병 모델 마우스를 이용한 시험에서는 이식 직후의 리포좀화α-GalCer 투여에 의해 기증자Treg가 증식하고 마우스의 생존율이 현저하게 개선되는 것이 인정되었다(그림4)[25].
이 비임상시험 데이터를 바탕으로 리포좀화α-GalCer의 치험제제 RGI-2001을 사용한 임상시험이 미국 실시되고 있다(NCT01379209). RGI-2001을 투여하여 혈중 Treg가 상승한 환자의 급성 GVHD 발병률이 극히 낮았던 것으로 보고되었다[26].
또 이식 후 21일째까지 혈중 Treg 비율이 현저히 상승한 환자에서는 만성 GVHD 발병도 억제되고 있는 것으로 시험 후 조사에서 인정받고 있다.
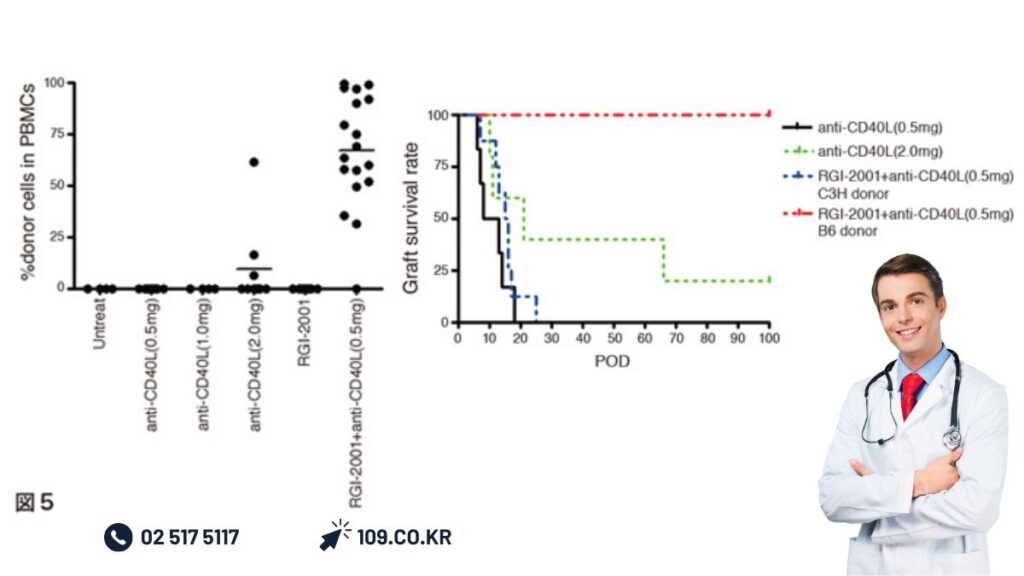
장기이식에 대한 RGI-2001의 응용에 대해서는 정상 레시피엔트 마우스에 아치사성 방사선 조사 후에 기증자 마우스 골수세포를 RGI-2001과 항CD40 리간드 중화항체를 동시 투여함으로써 혼합 골수 키메라 형성과 이식 기증자 심장의 장기 생착이 인정되었다(그림5)[27].
골수이식 전부터 당일 항CD25 중화항체를 대량 투여하여 Treg 증식을 저해하면 혼합 키메라 형성이 해제되었으나 이식 14일 후 항CD25 중화항체를 대량 투여하여도 혼합 키메라 형성에 영향이 없었으므로 이식 직후 레시피엔트 유래 Treg 증식이 혼합 키메라 형성에 필수적임을 시사하였다[28].
결론
20세기 후반 기린맥주 주식회사 연구자들이 오키나와 해면에서 추출한 아겔라스핀류를 항종양 활성을 지표로 최적화해 전합성한 알파-GalCer가 사실 정맥 내 복수회 투여에서는 항종양 활성보다 면역제어 활성이 높아지는 사실은 21세기가 되도록 알려지지 않았다.
현재 iNKT 세포의 항종양 활성을 유도하는 방법으로 알파-GalCer 펄스DC 요법이나 인공 아주반트 벡터법이 개발되면서 알파-GalCer를 이용한 암 치료는 다시 각광받기 시작했다.
한편, 리포좀화 알파-GalCer는 단독으로 투여함으로써 iNKT 세포의 면역제어 기능을 선택적으로 끌어낼 수 있으므로 이식면역관용유도뿐만 아니라 염증성 장질환(궤양성 대장염과 크론병), 자가면역질환(I형 당뇨병이나 다발성 경화증), 알레르기 질환의 치료, 나아가 효소 보충요법에서의 효소활성 저해 IgG 항체나 아나필락시스의 원인이 되는 IgE 항체의 생산 억제에 응용할 수 있는 잠재력을 가지고 있다.
참고문헌
- Yankelevich B, Knobloch C , et al. (1989) A novel cell type responsible for marrow graft rejection in mice. T cells with NK phenotype cause acute rejection of marrow grafts. J Immunol 142:3423-3430.
- Lee PT, Putnam A, et al. (2002) Testing the NKT cell hypothesis of human IDDM pathogenesis. J Clin Invest 110:793-800.
- Makino Y, Kanno R, et al. (1995) Predominant expres- sion of invariant Vα14+ TCR α chain in NK1.1+ T cell populations. Int. Immunol. 7:1157–1161.
- Koseki H, Imai K, et al. (1990) Homo- genous junctional sequence of the V14+ T-cell antigen receptor α chain expanded in unprimed mice. Proc. Natl. Acad. Sci. USA 87:5248–5252.
- Natori T, Morita M, et al., (1994) Agelasphins, novel antitumor and immunostimulatory cerebrosides from the marine sponge agelas-mauritianus. Tetrahedron 50:2771-27784.
- Morita M, Motoki K, Akimoto K, et al. (1995) Structure-activity relationship of alpha- galactosylceramides against B16-bearing mice. J Med Chem 38:2176-2187.
- Brennan, P.J., Brigl, M. & Brenner, M.B. (2002) Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nat. Rev. Immunol. 13, Feb;13(2):101-117.
- Gumperz JE, Miyake S, et al. (2002) Functionally distinct subsets of CD1d-restricted natural killer T cells revealed by CD1d tetramer staining. J Exp Med 195: 625–636.
- Lee PT, Benlagha K, et al. (2002) Distinct functional lineages of human Va24 natural killer T cells. J Exp Med 195: 637–641.
- Crowe NY, Coquet JM, et al. (2005) Differential antitumor immunity mediated by NKT cell subsets in vivo. J Exp Med 202: 1279–1288.
- Constantinides MG, McDonald BD, et al. (2014) A committed precursor to innate lymphoid cells. Nature 508(7496):397-401.
- Terashima A, Watarai H, et al. (2008) A novel subset of mouse NKT cells bearing the IL-17 receptor B responds to IL-25 and contributes to airway hyperreactivity. J Exp Med 205: 2727–2733.
- Stock P, Lombardi V, et al. (2009) Induction of airway hyperreactivity by IL-25 is dependent on a subset of invariant NKT cells expressing IL-17RB. J Immunol 182: 5116–5122.
- Watarai H, Etsuko Sekine-Kondo, et al. (2012) Development and function of invariant natural killer T cells producing TH2- and TH17-cytokines. PLoS Biol. 10, e1001255.
- Savage, AK, Constantinides MG, et al. (2008) The transcription factor PLZF directs the effector program of the NKT cell lineage. Immunity 29, 391–403.
- Kovalovsky, D, Uche OU, et al. (2008) The BTB-zinc finger transcriptional regulator PLZF controls the development of invariant natural killer T cell effector functions. Nat. Immunol. 9, 1055–1064.
- Kain L, Webb B, et al. (2014) The identification of the endogenous ligands of natural killer T cells reveals the presence of mammalian α-linked glycosylceramide. Immunity 41, 543-554.
- Fujii S, Shimizu K, et al. (2002) Prolonged IFN-g-producing NKT response induced with a-galactosylceramide-loaded DCs. Nat. Immunol. 3: 867–874.
- Parekh VV, Wilson MT, et al. (2005) Glycolipid antigen induces long- term natural killer T cell anergy in mice. J. Clin. Invest. 115: 2572–2583.
- Uldrich AP, Crowe NY, et al. (2005) NKT cell stimulation with glycolipid antigen in vivo : costimulation-dependent expansion, Bim-dependent contraction, and hyporesponsiveness to further anti- genic challenge. J. Immunol. 175: 3092–3101.
- Giaccone G, Punt CJ, et al. (2002) A phase I study of the natural killer T-cell ligand alpha-galactosylceramide (KRN7000) in patients with solid tumors. Clin Cancer Res. 8(12):3702-3709.
- Birkholz AM, Girardi E, et al. (2015) A Novel Glycolipid Antigen for NKT Cells That Preferentially Induces IFN-γ Production. J Immunol. 195(3):924-933.
- Wingender G, Birkholz AM, et al. (2015) Selective Conditions Are Required for the Induction of Invariant NKT Cell Hyporesponsiveness by Antigenic Stimulation. J Immunol. 195(8):3838-3848.
- Ishii Y, Nozawa R, et al. (2015) Selective Conditions Are Required for the Induction of Invariant NKT Cell Hyporesponsiveness by Antigenic Stimulation. J Immunol. 195(8):3838-3848.
- Duramad O, Laysang A, et al. (2011) Pharmacologic Expansion of Donor-Derived, Naturally Occurring CD4(+)Foxp3(+) Regulatory T Cells Reduces Acute Graft-versus-Host Disease Lethality Without Abrogating the Graft-versus-Leukemia Effect in Murine Models. Biol Blood Marrow Transplant 17(8):1154-1168.
- Chen Y-B, Efebera YA, et al. (2016) The Safety and Tolerability of RGI-2001 in the in vivo Modulation of Regulatory T-cells (Tregs) in Patients Undergoing Allogenic Hematopoietic Stem Cell Transplantation (AHSCT) in a First-in-Human (FIH) Phase I/IIa Dose-Finding Study. 42nd Annual Congress of the European Group for Blood and Marrow Transplantation, Valencia, Spain, April 2006
- Hirai T, Ishii Y, et al. (2014) A Novel Approach Inducing Transplant Tolerance by Activated Invariant Natural Killer T Cells with Co-stimulatory Blockade. Am J Transplant 14(3):554-567.
- Hirai T, Ishii Y, et al. (2016) Clonal Deletion Established via Invariant NKT Cell Activation and Costimulatory Blockade Requires In vivo Expansion of Regulatory T cells. Am J Transplant 16(2):426-439.
작성
이시이 야스유키리학 박사
이화학연구소 산업연계본부
창약·의약기술 기반 프로그램 프로젝트 리더
발췌: 일본MBL 번역
